Интуитивно человечество начало использовать антибиотики задолго до их «официального» открытия. Так, древние цивилизации применяли для лечения травы, мёд, животные продукты. Причём нередко наиболее эффективными оказывались именно испорченные «лекарства»: плесневелый хлеб, скисшее молоко, стухшее мясо.
В древности люди интуитивно использовали естественные средства, содержащие антибиотики.
Их полезный эффект заключался в том, что они были «пропитаны» плесенью, которая при прикладывании на рану или употреблении внутрь вела свою привычную жизнь: защищалась от агрессивной окружающей среды с помощью особых антибактериальных веществ.
Греки использовали плесневелый хлеб для дезинфекции ран и лечения кожных воспалений. В Древней Руси для этих же целей применяли тёплую землю.
В Междуречье врачи давали пациентам забродивший суп с черепашьими панцирями и змеиными шкурами, а заболевания глаз лечили компрессами со смесью лягушачьей жёлчи и скисшего молока.
Лишь столетия спустя врачи и учёные поняли, что причина гнойных ран и многих заболеваний — невидимые глазу существа (бактерии), которые могут проникнуть в организм с грязью на руках или медицинских инструментах.
Бактерии открыл голландский учёный Антони ван Левенгук, который разработал первый микроскоп.

Первый в мире микроскоп, разработанный Антони ван Левенгуком
В поисках средств для борьбы с бактериями исследователи вновь вспомнили о древнем «лекарстве» и стали пристально изучать целебные свойства плесени.
Так, в XVII–XIX веках англичане активно экспериментировали с разными видами плесени и выяснили, что на посевах, покрытых ею, не вырастают бактерии. А в 1897 году во Франции Эрнест Дюшен вылечил от брюшного тифа морских свинок с помощью плесени (Penicillium glaucum). Он разбавлял её водой и вводил лабораторным животным.

Лечебная плесень Penicillum glaucum, с которой экспериментировал Эрнест Дюшен, до сих пор применяется для изготовления сыра горгондзола
В разных уголках мира исследователи обнаружили полезную плесень и экспериментировали с лечением распространённых инфекций. Причём достаточно успешно. Но эпохальным открытие антибактериальных свойств плесневых грибков было признано гораздо позже.
Великая нечистоплотность Флеминга
В 1928 году сэр Александр Флеминг изучал в своей лаборатории в Англии бактерии семейства Staphylococcaceae (стафилококки). Учёный выращивал множество колоний в чашках Петри, а потом сделал паузу — уехал в отпуск. При этом посуду со своими экспериментами он не вымыл как следует, а какие-то чашки и вовсе простояли несколько недель нетронутыми.
Когда учёный вернулся, то заметил, что посевы покрылись плесенью, а вокруг плесневых «шапок» совсем не было бактерий.
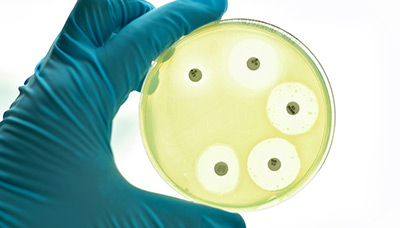
Плесень в чашке с колонией бактерий. Прозрачные круги — области, где действует пенициллин
Флеминг изучил «губительную» плесень и понял, что бактерии погибли из-за специфического «сока», который она выделяет. Учёный назвал его пенициллином, в честь рода плесени Penicillus, которая и уничтожила колонии стафилококка.
Александру Флемингу не удалось выделить чистый пенициллин (в экспериментах он использовал отфильтрованный «бульон»), он не смог определить, к какому виду относится целительная плесень (спустя 2 года оказалось, что это Penicillium notatum), но подробно описал, как она воздействует на разные бактерии, сравнил одни виды плесени с другими, а главное — сохранил образцы и рассылал их заинтересовавшимся коллегам.
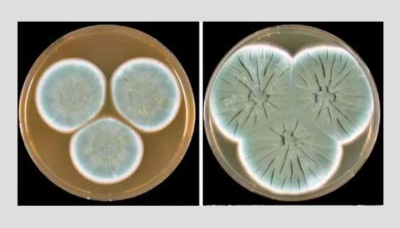
Колонии плесени рода Penicillus, с которой экспериментировал Флеминг. Фото: Houbraken, J., Frisvad, J.C. & Samson, R.A
Один такой образец почти 10 лет хранился в Оксфордском университете. В 1939 году учёный Эрнст Чейн выделил из него чистый пенициллин, а его начальник Говард Флори успешно испытал препарат на животных.
Чашку Петри, благодаря которой Флеминг сделал открытие, вместе с той самой плесенью в 2017 году продали на аукционе за 14 тысяч долларов.
Первым подопытным человеком стал 45-летний английский офицер полиции Альберт Александр. В декабре 1940 года он поранился шипом розы в своём саду и занёс в рану стафилококковую и стрептококковую инфекцию. К моменту испытаний (февраль 1941 года) он считался безнадёжным, ведь ему не помог ни один из имеющихся методов лечения: инфекция распространялась по организму, лицо покрылось гнойными язвами, а один глаз и вовсе пришлось удалить.

Александр Флеминг в своей лаборатории
Уже в первые сутки после введения пенициллина состояние Альберта резко улучшилось: уменьшилось нагноение, спала температура. Но запасов лекарства у учёных не хватало для завершения курса лечения.
Учёные фильтровали мочу пациента, чтобы добыть хотя бы крохи пенициллина. Этого оказалось недостаточно, Альберт Александр скончался от сепсиса.
Несмотря на перспективы использования пенициллина, британские фармацевтические компании не особенно заинтересовались в производстве нового лекарства: они были завалены оборонными заказами. Чтобы открытие не пропало, учёные решили передать его США, но это было крайне рискованное мероприятие, потому что такое перспективное лекарство могло изменить ход войны, а значит, нельзя было допустить, чтобы оно попало в руки фашистов.
Чтобы вывезти образцы плесени, британцы придумали хитрый ход: пропитали грибковыми спорами пальто и таким образом переправили открытие за океан.
Колонии плесневых грибов рода Penicillium в чашках Петри
В Америке пенициллином очень заинтересовались и даже нашли родственную британской плесень, которая выделяла в 6 раз больше лекарства. Плесень стали выращивать в огромных баках и отправлять на фронт.В конце 1942 года в американских лабораториях синтезировали менее 100 доз пенициллина, в 1943-м выпустили уже 21 миллиард доз, а в 1945-м — 6,8 триллиона доз.

Эрнст Чейн (слева) и Говард Флори (справа). Лауреаты Нобелевской премии по физиологии и медицине 1945 года (совместно с А. Флемингом)
После успеха пенициллина учёные по всему миру начали поиск других антибиотиков. Так, в 1952 году в почве с острова Борнео нашли микроорганизмы Streptomyces orientalis и выделили из них ванкомицин. Лекарство начали применять в 1958-м. В 1960-х годах начали появляться цефалоспорины — усовершенствованные пенициллины, которые работают против устойчивых бактерий.
Благодаря открытию антибиотиков средняя продолжительность жизни между 1944 и 1972 годами увеличилась на 8 лет. В основном это произошло за счёт того, что дети и молодые люди перестали умирать от ранее неизлечимых инфекций.
Как антибиотики убивают бактерии
Антибиотики уничтожают бактерии двумя способами: разрушают клеточную стенку или генетический аппарат микробов.
Антибиотики, разрушающие клеточную стенку
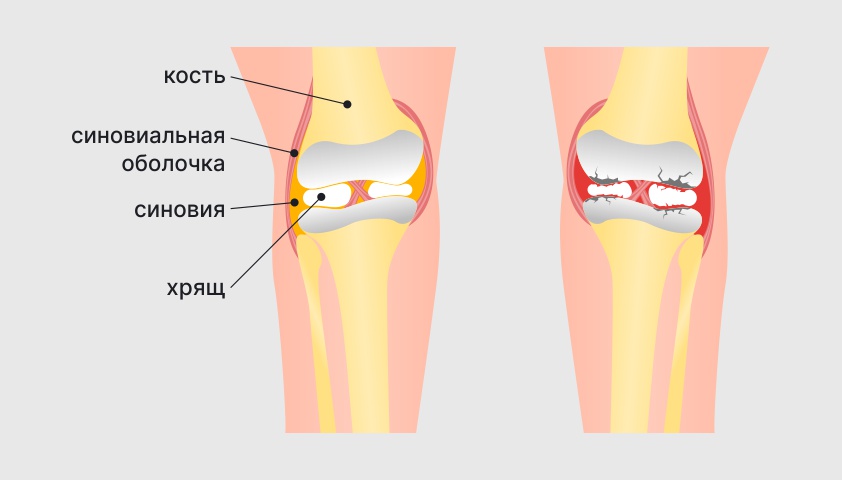
Клеточная стенка как броня защищает микроорганизм от внешних разрушающих факторов, помогает поддерживать форму клетки, регулирует баланс жидкости и питательных веществ внутри неё. Без клеточной стенки бактерии погибают от изменения pH, водного баланса, температуры и других факторов.
В этот класс входят β-лактамы (пенициллины, цефалоспорины, карбопенемы), гликопептиды (ванкомицин), полимиксины (колистин). Такие антибиотики применяют для лечения широкого спектра инфекций, в том числе гонореи, хламидиоза, некоторых кишечных инфекций, пневмонии.
Колистин — один из самых сильных антибиотиков, препарат «последней надежды». Его используют в лечении инфекций, вызванных устойчивой госпитальной флорой, а также тогда, когда другие антибактериальные средства оказались бессильны.
Слово «антибиотик» образовано от греческих морфем ἀντί («против») и βίος («жизнь»).
Антибиотики, разрушающие генетический аппарат бактерий
Некоторые антибактериальные препараты могут проникать в «сердце» бактерий и нарушать процесс синтеза ДНК, передачи генетической информации, выработки белков, необходимых для построения бактериальной клетки. В результате микробы утрачивают способность расти и размножаться.
К этому классу относят тетрациклины, макролиды, фторхинолоны, сульфаниламиды. Их применяют при туберкулёзе, туляремии, чуме, бруцеллёзе, сепсисе, раневых, ожоговых, а также других инфекциях.
Кроме того, антибиотики бывают узкого и широкого спектра действия. Препараты узкого спектра работают против ограниченного числа бактерий, например только против стафилококков. Их назначают в тех случаях, когда точно знают, каким микробом вызвана инфекция.
Препараты широкого спектра действуют одновременно на много видов бактерий, поэтому обычно применяются, когда времени на поиск «виновника» инфекции нет, а лечение нужно начать как можно скорее.
Антибиотики убивают не только патогенные бактерии, попутно они уничтожают и представителей нормальной микрофлоры кишечника.
Фатальный сценарий: где не обойтись без антибиотиков
Антибиотики — мощный инструмент, который используется не только для лечения инфекционных заболеваний. Антибактериальная терапия применяется в хирургии, неонатологии, онкологии и многих других областях медицины.
Лечение инфекционных заболеваний
Благодаря антибиотикам люди перестали умирать от раневых инфекций
Антибиотики стали настоящей революцией в медицине: большинство заболеваний, вызываемых болезнетворными бактериями, перешли из разряда смертельных в излечимые. Так, люди перестали столь часто умирать от раневых и нейроинфекций, пневмонии, инфекций, передаваемых половым путём (ИППП).
Ежедневно в мире более 1 миллиона человек в возрасте от 15 до 49 лет заражаются ИППП. Не умереть от таких инфекций и их последствий помогают антибиотики.
Хирургия
Антибиотики перед операцией — эффективный способ профилактики осложнений и возможность сократить период восстановления
Все операции, даже самые незначительные, вроде иссечения фурункула, без антибиотиков становятся очень рискованными. Дело в том, что любая открытая рана — идеальные входные ворота для инфекции, потому что бактерии или другие патогены могут попасть сразу в кровь, минуя все защитные системы организма.
Акушерство и неонатология

Инфекции могут обернуться гибелью плода, задержкой его развития и врождёнными пороками. Антибиотики помогают спасти мать и ребёнка
В группу риска по заражению инфекционными заболеваниями в родильном зале или отделении реанимации входят в первую очередь ослабленные, недоношенные и родившиеся от инфицированных матерей дети. Но и здоровые младенцы, родившиеся в срок, могут пострадать от тяжёлых инфекций.
Их иммунная система только учится работать как следует, поэтому не может защитить от патогенных бактерий и других угроз. Из-за этого младенческая смертность до изобретения антибиотиков была очень высокой.
Кроме того, около 15–20% родов во всём мире проводится с помощью кесарева сечения. Для этого брюшную стенку разрезают, чтобы безопасно извлечь ребёнка. Такой разрез представляет потенциальную угрозу, потому что в открытую рану могут попасть инфекции.
Женщинам с осложнённым течением беременности и угрозой разрыва плодных оболочек проводят профилактическую антибиотикотерапию, чтобы избежать тяжёлых инфекционных осложнений у матери и ребёнка. Без антибиотиков такая профилактика также будет невозможной.
Лечение онкологических заболеваний

Антибиотики помогают ослабленной иммунной системе онкопациентов справиться с возможными инфекциями и их последствиями
Химиотерапия и лучевая терапия — два наиболее распространённых метода лечения рака, которые серьёзно вредят иммунной системе пациентов. В результате организм не может противостоять даже относительно безобидным инфекциям, а контакт с бактериальной флорой может стать летальным.
Поэтому пациентам, которые проходят курс лечения от онкологического заболевания, могут рекомендовать антибиотики с профилактической целью, чтобы предупредить опасные последствия.
Трансплантология
Чтобы предотвратить отторжение пересаженных органов и тканей, пациенты вынуждены принимать препараты, искусственно подавляющие иммунную систему. В результате появляются те же проблемы, что и при лечении рака: организм не может противостоять болезнетворным бактериям, как и другим возбудителям (вирусам, грибам). Без антибиотиков период приживления трансплантата осложняется развитием инфекций.
Почему антибиотики перестают работать
С 1980-х не было открыто ни одного нового класса антибиотиков, учёные лишь модифицируют существующие препараты. На то есть несколько причин. Среди основных — достаточное разнообразие уже существующих лекарств и экономическая невыгодность производства антибактериальных средств.
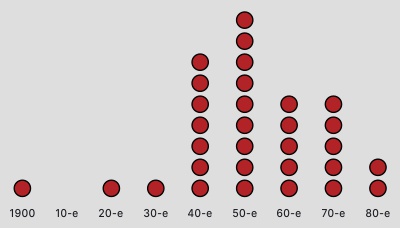
Количество разработанных антибиотиков в разные десятилетия ХХ века. Последний был открыт в 1984 году (по данным информагентства Bloomberg)
За последние 20 лет многие крупные фармацевтические компании вроде Johnson & Johnson, Roche, Pfizer, Eli Lilly and Company, Bristol-Myers Squibb сократили разработку новых антибиотиков или вообще закрыли проекты по их созданию. Дело в том, что появились другие востребованные и в то же время более прибыльные области. Например, производство лекарств для лечения хронических заболеваний: сахарного диабета, артериальной гипертензии, депрессии.
В среднем антибиотики начинают приносить прибыль только через 23 года после выпуска. А на запуск одного лекарства у компании уходит около 1 миллиарда долларов.
Разработка нового лекарства — очень затратное мероприятие, ведь, помимо тестирования в лаборатории, нужно подтвердить эффективность и безопасность на людях, пройти многочисленные проверки от регулирующих органов. Лишь единицы из исследуемых молекул в итоге выходят на рынок. После таких испытаний компания-производитель ожидаемо хочет получить прибыль.
Но, учитывая, что бактерии очень быстро учатся вырабатывать устойчивость к новым лекарствам, высока вероятность, что перспективный препарат в скором времени окажется неэффективным и его просто перестанут применять. В случае с препаратами для лечения хронических неинфекционных заболеваний риски гораздо ниже.
Эволюция бактерий
Чтобы выжить, бактерии научились мутировать, то есть приобретать новые способности, которые помогают им противостоять агрессивным факторам окружающей среды. Одни в процессе эволюции научились обходиться без кислорода, другие отрастили жгутики, с помощью которых смогли передвигаться, третьи нарастили толстую «броню», четвёртые вообще научились вырабатывать ферменты, разрушающие антибиотики. А учитывая, что бактерии — короткоживущие организмы, которые выживают за счёт того, что стремительно размножаются путём простого деления, новые способности очень быстро наследуются потомками.
Процесс деления бактерий в благоприятных условиях очень интенсивный: в среднем каждый час у одной клетки появляется дочерняя копия.
Всего за сутки у бактерии может появиться столько поколений «наследников», сколько у людей родилось со времён Ивана Грозного.
Бактерии могут делиться полезными для выживания мутациями не только с дочерними клетками, но и между собой. Такой процесс называется горизонтальный перенос генов. Так, бактерии, которые обрели защитный механизм, могут поделиться им с «соседями». Причём не обязательно родственными.
Ещё Флеминг заметил, что некоторые бактерии научились защищаться от пенициллина, а после и от других антибиотиков. По прошествии многих лет разрабатывать новые антибиотики стало сложнее.
Как антибиотикорезистентность оставляет человечество безоружным против инфекций
В 1946 году резистентность к пенициллину выявили у 14% заболевших, в 1950-м — уже у 59%, а к 1990-му — у 95%, поэтому для дальнейшего успешного применения пришлось менять формулы, разрабатывать пенициллины следующих поколений.Сейчас ВОЗ называет устойчивость к антибиотикам одной из главных опасностей для глобального здравоохранения. По оценкам экспертов, с каждым годом из-за неё становится всё труднее лечить пневмонию, туберкулёз, гонорею, сальмонеллёз и другие инфекции.
Из-за устойчивости к антибиотикам ежегодно умирает 700 000 человек. Ожидается, что к 2050 году это число возрастёт до 10 миллионов. То есть устойчивые бактерии приведут к большему количеству смертей, чем рак.
Бактерии, устойчивые к антибиотикам:
- ацинетобактер (Acinetobacter baumannii),
- синегнойная палочка (Pseudomonas aeruginosa),
- энтеробактерии (Enterobacteriaceae),
- энтерококк фэциум (Enterococcus faecium),
- золотистый стафилококк (Staphylococcus aureus),
- хеликобактер пилори (Helicobacter pylori),
- кампилобактер (Campylobacter),
- сальмонелла (Salmonella),
- гонококк (Neisseria gonorrhoeae),
- пневмококк (Streptococcus pneumonia),
- гемофильная палочка (Haemophilus influenzae),
- шигелла (Shigella),
- клебсиелла пневмонии (Klebsiella pneumonia),
- кишечная палочка (Escherichia coli),
- метициллинустойчивые штаммы золотистого стафилококка (MRSA).
От устойчивого к антибиотикам туберкулёза ежегодно умирает около 250 тысяч человек.
Масштабы резистентности
MRSA
Более 50 лет назад начали появляться штаммы золотистого стафилококка, устойчивые к антибиотику метициллину, известные как MRSA (Methicillin-resistant Staphylococcus aureus). Эти бактерии чаще других становятся нечувствительными к антибиотикам и убивают более 15 тысяч человек ежегодно.
Энтерококки, устойчивые к ванкомицину, — причина госпитальных инфекций. В США ежегодно фиксируется около 66 тысяч случаев заражения такими энтерококками.
Пневмококк Streptococcus pneumoniae, устойчивый к амоксициллину и азитромицину, может стать причиной тяжёлой бактериальной пневмонии и менингита. Резистентность усложняет лечение и приводит к 7 тысячам смертей ежегодно.
Появление устойчивости бактерий — естественный процесс, но эксперты заявляют, что человечество зачастую само ускоряет её формирование.
Бесконтрольный приём антибиотиков
На протяжении десятков лет антибиотики были в свободном доступе, поэтому люди лечили ими всё подряд: от простуды до диареи. Это привело к формированию новых устойчивых бактерий, недостаточно чувствительных к имеющимся антибактериальным средствам.
Антибиотики эффективны только против бактерий, поэтому вирусные инфекции с их помощью не вылечить (если нет бактериальной суперинфекции). При этом многие продолжают принимать антибиотики без показаний.
Нарушение схемы приёма антибиотика тоже способствует выработке резистентности возбудителя. Нередко пациент принимает их недостаточно длительно или в недостаточной дозе, лечится до уменьшения симптомов, а потом прекращает курс по своей инициативе. Бактериальный возбудитель при этом не выводится из организма полностью, зато приобретает опыт контакта с антибиотиком и нарабатывает механизмы устойчивости.
Слишком низкая концентрация антибиотика не убивает бактерии, зато позволяет им приспособиться к препарату, как к неблагоприятному фактору вроде холода или аномальной pH.
Антибиотики назначают необоснованно не только при простуде, но и при многих других заболеваниях. Так, часто их применяют в гинекологии и урологии. Один из классических примеров — бессимптомная бактериурия, при которой в анализе мочи случайно выявляют большое количество патогенных бактерий. При этом человека ничего не беспокоит.
Часто таким пациентам назначают антибиотики, чтобы вылечить воспаление, но лечение никак не меняет жизнь человека, зато отлично «тренирует» бактерии. Исследования последних лет показали, что бессимптомная бактериурия — один из вариантов комменсализма (безопасного сожительства бактерий в организме хозяина). Она может быть даже полезной в плане поддержания перекрёстного иммунитета к другим бактериям. Поэтому многие эксперты считают, что это состояние не требует лечения, если не проявляется симптомами (принцип «не лечить анализы»). Пациентов с бессимптомной бактериурией наблюдают в динамике.
В развитых странах антибиотики редко можно купить без рецепта врача, но бактерии всё равно приобретают устойчивость. Отчасти виновны в этом страны, в которых такие лекарства до сих пор можно купить свободно. Такая ситуация характерна, например, для Индии, где в 2020 году было продано около 216 миллионов избыточных доз антибиотиков.
Индия — рекордсмен по доле резистентных штаммов бактерий. Более 50% образцов клебсиеллы пневмонии здесь устойчивы к карбапенемам, препаратам широкого спектра действия.
Общемировое потребление антибиотиков с 2000 по 2010 год выросло больше чем в три раза. В основном за это ответственны пять стран — Бразилия, Россия, Индия, Китай и Южно-Африканская Республика (БРИКС).
«Я хотел бы озвучить одно предупреждение. Пенициллин во всех случаях нетоксичен, поэтому не стоит бояться передозировки и отравлений. Опасность кроется в малой дозе. Не составляет труда создать устойчивые к пенициллину микроорганизмы в лабораторных условиях, выдерживая их в концентрациях, неспособных их убить, и то же самое может случайно произойти в вашем теле.
Настанут времена, когда любой сможет купить пенициллин, поэтому есть опасность, что какой-нибудь несведущий человек может легко принять слишком малую дозу и вырастить в себе микроорганизмы под влиянием низких концентраций лекарства, которые будут устойчивы к пенициллину». (А. Флеминг)
Сельское хозяйство
Известно, что антибиотики полезны не только для людей, но и для бизнеса. Так, внедрение антибиотиков в животноводство помогло успешно лечить животных, поддерживать благополучную эпидемиологическую обстановку и обеспечивать безопасность продуктов животноводства для людей. Причём используются для этого антибиотики тех же групп, которыми лечат инфекции у людей.

По меньшей мере половина всех производимых антибиотиков применяется в сельском хозяйстве
В результате бактерии, которые приобрели устойчивость в организме животных, заражают и человека: через прямой контакт, окружающую среду или продукты (молоко, яйца, мясо).
Так, нередко эксперты Роспотребнадзора выявляют антибиотики при проверке молочной и мясной продукции: сметаны, кефира, полуфабрикатов из курицы и свинины.
На самом деле использование антибиотиков для лечения животных не так страшно, главное — соблюдать правила безопасности. Во время лечения и пару недель после животное должно «отдохнуть»: мясо и другие продукты, получаемые от него, не должны попасть в производство. За этот период антибиотики выводятся из организма. Но это вынужденный простой, а значит, потеря прибыли. Некоторые фермеры не соблюдают такие меры предосторожности, в результате на прилавках оказываются напичканные антибиотиками продукты.
Помимо привычных мясных и молочных продуктов, антибиотики находят и в мясе рыб, а также в некоторых морепродуктах. Так, выяснилось, что вода в каналах Санкт-Петербурга имеет явный антибактериальный эффект. Дело в том, что антибиотики попадают в неё из очистных сооружений.
В результате, например, скользкие ерши в водоёмах потеряли защитный слой слизи. В новых условиях она оказалась им попросту не нужна, ведь они плавают в растворе антибиотиков.
Следовые количества антибиотиков обнаружили даже в мёде. Эксперты высказали предположение, что пчеловоды могут использовать лекарства для профилактики и лечения аскосфероза — инфекционного заболевания, которое поражает личинок трутней и молодых пчёл.
Супербактерии
Супербактериями называют микроорганизмы, которые смогли выработать устойчивость ко всем известным антимикробным препаратам. Такое явление было отмечено относительно недавно.
2008 год — в индо-пакистанском регионе зарегистрировали заражение людей бактериальной инфекцией, на которую не влияли никакие антибиотики. Случаи были единичные, но сам факт полирезистентности встревожил врачей и учёных.
2010 год — стало известно, что штаммы супербактерий глобально распространены по всему миру. Предположительно, это связано с поездками людей в страны индо-пакистанского региона, откуда они и привозят опасные бактерии.
2016 год — 70-летняя американка вернулась из путешествия в Индию. В поездке она сломала ногу, попала в местную больницу и там заразилась супербактерией Klebsiella pneumoniae. Боль в ноге не проходила, а по возвращении из поездки у женщины началось сильное воспаление. В американской больнице врачи испробовали все известные на тот момент антибиотики, но ни один из 26 препаратов не помог. В результате женщина умерла от септического шока.
Позднее случаи заражения также были выявлены в Швеции, Бельгии, США, Канаде, Великобритании. Эксперты говорят, что большинство больных заразились именно во время пребывания в медицинских учреждениях.
В больницах применяют широкий спектр антибактериальных препаратов, а также антисептиков, поэтому бактерии вырабатывают устойчивость сразу ко многим из них и быстро передаются среди пациентов и персонала.
Пути преодоления антибиотикорезистентности
Каждая страна вырабатывает свои способы решения проблемы. Так, в Евросоюзе с 2006 года запрещено использовать антибиотики в кормах для животноводства. В России с 2017 года ограничивают антибактериальные препараты в применении: аптекам запрещено продавать их без рецепта врача. В феврале 2018 года ВОЗ выпустила рекомендации, объясняющие, как сдержать антибиотикорезистентность, для всех групп, участвующих в процессе лечения: пациентов, врачей, фармацевтов, представителей власти, фармацевтических компаний и сельского хозяйства.
Основные правила преодоления антибиотикорезистентности для пациентов:
- принимать антибиотики только по назначению врача и проходить строго весь курс лечения;
- не делиться оставшимися антибиотиками с другими;
- мыть руки и соблюдать правила гигиены при приготовлении пищи;
- исключить или минимизировать контакты с больными людьми;
- практиковать безопасный секс;
- проходить вакцинацию в полном объёме.
Для врачей разработаны правила рациональной антибиотикотерапии — ежегодно обновляемые справочники, в которых указано, как, когда и в каком объёме следует назначать антибиотики. Например, при бактериальной инфекции Х следует назначать сначала препарат А, если он не помогает, то через такое-то время препарат Б и только потом препарат В. Препараты второй, третьей и далее линий врачи стараются не использовать без крайней необходимости.
Сначала, как правило, эмпирически назначается антибиотик широкого спектра, затем (когда готовы результаты посева на чувствительность к антибиотикам) он может быть заменён на препарат более узкого спектра, при недостаточной эффективности назначаются комбинации антибиотиков.
Препараты первой линии, как правило, лучше переносятся, стоят дешевле и обладают обширной доказательной базой. При нерациональном использовании антибиотиков есть риск досрочно перейти на препараты следующих линий и на последний рубеж, после которого в арсенале ничего не останется.
Подобрать антибиотик, который с вероятностью 99% поможет победить бактерию, можно только по результатам посева с определением антибиотикочувствительности.
Альтернатива антибиотикам
Для защиты от инфекционных болезней существуют и альтернативы антибиотикам.
Способы профилактики и лечения инфекционных болезней:
- пассивная иммунизация (введение препаратов с готовыми антителами);
- активная иммунизация (вакцинация);
- фаговая терапия (лечение с помощью вирусов, например бактериофагов);
- применение антисептиков.
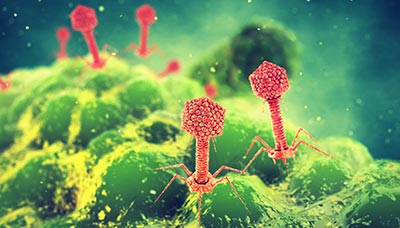
Бактериофаги — это вирусы, которые убивают бактерии, но не вредят другим живым организмам
Один из самых перспективных способов — фаговая терапия. Каждый вид бактериофагов (а их миллионы) эффективен только против «своего» вида бактерий. Но вот процесса, аналогичного антибиотикорезистентности, при их взаимодействии с микробами не возникает, потому что бактериофаги — это вирусы и они тоже умеют меняться. Когда бактерия приспосабливается и вырабатывает устойчивость, фаг может найти к ней новый «ключ» и добиться своего.
Так же как и антибиотики, бактериофаги относятся к антибактериальным средствам. В целом они выполняют одну и ту же работу — уничтожают бактерии, правда, делают это по‑разному. Но бактериофаги не могут полностью заменить антибиотики, потому что каждый вид фага действует против определённой бактерии. Между тем пациенту в большинстве случаев требуется антибактериальная терапия на этапе, когда возбудитель ещё не идентифицирован.
Авторитетных масштабных исследований, которые подтвердили бы эффективность и безопасность фаговой монотерапии, по‑прежнему не хватает.
Для повышения эффективности противомикробной терапии и профилактики антибиотикорезистентности бактериофаги начали применять в комбинации с антибиотиками. Оказалось, их общее действие превышает сумму эффектов от каждого препарата по отдельности.
Можно ли затормозить распространение антибиотикорезистентности
Пока антибиотики не перестали работать, они до сих пор остаются самым эффективным средством для лечения бактериальных инфекций и ежедневно спасают миллионы жизней. Но каждый раз, когда люди используют их без острой необходимости и не соблюдают меры предосторожности, они помогают развитию и распространению антибиотикорезистентности. В результате страдают все: пациенты дольше находятся в больнице, государство тратит больше денег на медицинские расходы, а люди чаще умирают от бактериальных инфекций и их последствий.
Поэтому, чтобы сохранить эффективность антибиотиков и не вернуться в Средневековье с его смертельными эпидемиями, каждому стоит аккуратнее относиться к антибактериальной терапии: принимать антибиотики только по назначению врача, строго соблюдать прописанный курс лечения и не пить их на всякий случай. Помимо того, что, пренебрегая этими правилами, человек помогает распространению антибиотикорезистентности, течение его инфекций также может ухудшиться, а риск столкнуться с потенциально опасными побочными эффектами увеличивается в десятки раз.